荧光显微镜进行样品的免疫研究
免疫荧光(IF)是一种强有力的方法用于可视化细胞内过程,条件和结构。 中频制剂可通过各种显微技术(例如CLSM,落射荧光,TIRF,GSDIM)进行分析,根据应用或研究者的兴趣。同时,如果已经进行了大量具有至少获得一个简单的研究小组的成为不可或缺荧光显微镜。
一个IF试验的中心是两个不同的部件的组合:
首先,特异性抗体,其用于形成免疫复合物以标记所需的分子 - 在大多数情况下的蛋白质 - 细胞中。
其次, 荧光染料 ,其被耦合到所述的免疫复合物,因此在显微镜可视化的靶结构。
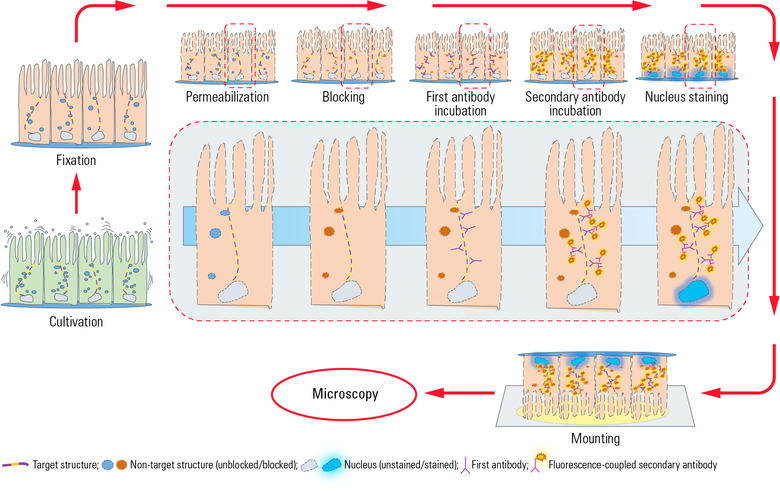
图1:本图显示了IF与上皮细胞贴壁生长盖玻片上的间接一个典型的工作流程。培养后,将细胞得到固定,因此杀死用化学交联剂(如甲醛)。在下一个步骤透用洗涤剂进行,使抗体穿过细胞膜。 阻断与正常血清,奶粉或牛血清白蛋白减少抗体对非靶结构的非特异性结合,以Zui小化假阳性信号。接下来,将与第一抗体温育发生,其特异性识别的表位上的目标分子。在第二孵育步骤中的荧光偶联的二次抗体施加其结合第一抗体,因此显示目标结构。 抗体温育后,细胞核染色用染料如DAPI或Hoechst的其中以插入的DNA进行的。安装用显微镜载玻片上的安装介质(如的Mowiol®或的Vectashield®)盖玻片后,中频准备准备显微镜。
直接与间接免疫荧光法
取决于实验的类型,有两种不同的IF变种:在直接或初级的IF被连接到一个荧光染料的特定初级抗体用于结合靶结构和它的直接可视化。
在第二变型中,被称为间接或仲中频,两步骤培养中进行。首先,一个特定的主抗体识别的靶结构。然后荧光染料偶联的二次抗体施加特异性结合的一次抗体。通过引导二次抗体对在其中一次抗体升高的物种(见获得该特异性的抗体和荧光染料)。两个IF变种相比,他们每个人都有不同的优点和缺点:
通过耦合第一抗体与荧光染料,直接中频比间接版本被省略费时洗涤和孵育步骤更快。因此,直接中频更容易处理,因此,适合于样品的快速分析中标准化的IF实验,例如,在临床实践中。 然而,有必要采用一种运行良好的一级抗体以高亲和力与它的抗原。 这是同时产生负面方面,由于荧光耦合和验证的初级抗体是昂贵的。此外,需要一个单独的第一抗体为每个目标的结构,并且该抗体与在直接中频荧光染料联动限制在设计实验相比,间接的IF你的灵活性。
这种灵活性是间接的IF的显著优势。一般,几个不同的目标结构在同一检体需要在一个被可视化的IF反应,因此离散荧光必须选择为每个目标分子。在间接中频,不同的荧光偶联的二级抗体可与不同的初级抗体(考虑当然的物种的反应性,)相结合。相反,如果你想“玩”与您的目标结构直接IF的色彩组合,您需要为每种颜色单独的主要抗体。间接方法的另一个优点是由第二抗体的信号放大。多个次级抗体分子可结合于一个初级抗体,从而导致增加的荧光,这意味着较少的初级抗体具有被应用。
间接IF的工作流程可能需要更多的时间,但由于一级和二级抗体一般更经济的过程中可能的组合是首选大多数研究人员的方法。
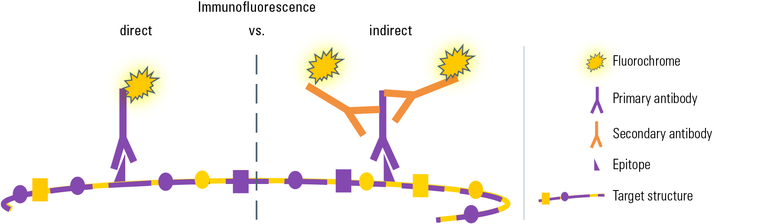
图2:有两种方法通过免疫荧光来可视化靶结构:在这两种变体的特定的第一抗体被用于识别在目标分子上的特定表位。 这里,目标分子由几个相同蛋白质亚基(=宏分子),因此它表现出相同类型的每个亚基的几个表位。 为了简化只有一个表位在这里描绘。
在直接中频第一抗体直接与荧光染料其中可视化,在显微镜下的目标结构。
在间接中频荧光偶联第二抗体在第二孵育步骤中,其特异性标记第一抗体使用。 这导致了更大的灵活性,在选择的抗体和荧光染料,此外,以信号放大,因为一些次级抗体分子可结合于一个初级抗体。
抗体和荧光染料
为高品质的IF染色的Zui重要工具是一个很好的一次抗体。 同时,一个或甚至几个商购的可购买的抗体可用于大约每种蛋白在几乎每个细胞类型。 但是,也有要注意这里的几个非常重要的事情。
为了使基于您如果一个严谨的科学或临床声明染色,你必须确保你的主要抗体与其靶抗原的特异性。这样做,你不应该完全依赖于你的商业供应商的声明。根据已使用和验证在文学上的主题主要抗体选择你的抗体。检查制造商的网站抗体的数据表IF染色可用的照片,并将其与您的期望或其他出版的插图进行比较。取该抗体的克隆性的通知,如单克隆抗体特异性结合仅一个表位,而多克隆抗体识别表位的数,使得非靶结构的非特异性标记的可能性较大。因此,利用它们的高特异性和亲和性良好的单克隆抗体通常是更昂贵的,但它们也能达到更好的效果。
如果要执行多色间接中频,不同的初级抗体必须从不同物种中为了区分免疫复合物通过用荧光偶联的二抗标记之后推导(见表1)。比方说,例如,你如果与抗体抗蛋白A来自小鼠抗体抗蛋白B兔和抗体抗蛋白C大鼠进行。 当选择二抗,你要记住,他们每个人的具体承认只有一个主抗体。 此外,在这三个次级抗体的本实施例的荧光染料必须不同于其波长光谱中,以显微镜分析鉴别它们的荧光信号。如今,从紫外线链接到荧光染料的波长范围的第二抗体,以从几乎任何种类是可购买红外线对初级抗体。因此研究者仅受可用的配置显微镜 (过滤套,激发激光器)。
靶蛋白 | 蛋白A | 蛋白B | 蛋白C |
|---|---|---|---|
目标物种 | 人的 | 人的 | 人的 |
第一抗体 | 抗蛋白A | 抗蛋白乙 | 抗蛋白C |
第一抗体反应的物种 | 小鼠抗人 | 兔抗人 | 鼠抗人 |
第二抗体反应的物种 | 山羊抗小鼠 | 山羊抗兔 | 山羊抗大鼠 |
荧光染料的激发/发射 | 五百二十五分之四百九十零纳米 | 五百七十三分之五百五十六纳米 | 665分之650纳米 |
表1:多色间接中频的本实施例说明了如何在同一细胞标记simultanously三种不同的蛋白质。 三个第一抗体必须从不同物种中,为了检测其与三个不同的荧光染料偶联的二抗派生。二级抗体“荧光必须有不同的wavelenght谱明显分析显微镜。在样本图像中描绘的细胞也被处理用Hoechst 33342进行核染色。Leica显微镜 TCS SP2上执行。

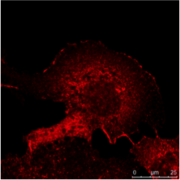
交叠 蛋白A 蛋白B 蛋白C
标本
中频协议,适用于各种不同的样品或样品的存在。Zui简单和Zui常用的方法是从细胞培养物中培养(真核)细胞的染色。贴壁生长的细胞可以接种在盖玻片,多孔-插入或直接在玻璃底培养皿中,并用于中频处所需的时间。如果还可能的应用的细胞的一个对象的载玻片之后悬浮细胞,例如,通过细胞离心涂片。在两种情况下,重点是在细胞内过程或结构的分析,而且这是一个指定免疫细胞化学(ICC)。
免疫组织化学(IHC),另一方面,蛋白质或分子的存在被检体以组织特异性上下文。这里,器官制剂(通常包埋在石蜡)的超薄切片被用于例如研究蛋白在健康器官中的表达相比,患病的。 在另外的组织切片的制备,也可以进行如果与整个生物体,一个过程被称为“整装的IHC”。 为了这个目的,不同的模式生物如小鼠,鸡或斑马鱼,例如,或植物模式生物像拟南芥的胚胎被使用。 在整装IHC一个是由试件的尺寸和相关的穿透深度对IF试剂的限制。单独的孵育步骤的时间比培养细胞的染色更长。 此外,显微镜用的大型的标本分析特殊光学设备必须是可用的。
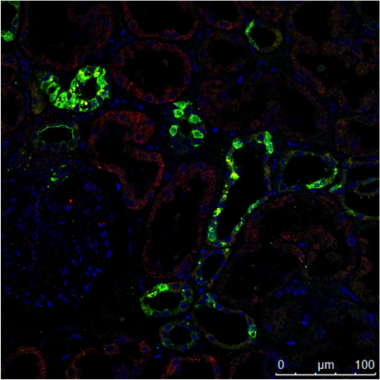

A) B)
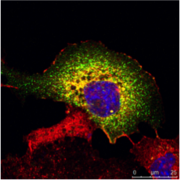
图3:A)一个人肾脏的免疫组织化学(IHC)染色显示不同结构不同的细胞类型(如Glomerolus,近曲小管,远曲小管)。 标记有绿色荧光蛋白的表达被限制在一个特定的细胞类型,而红色标记蛋白被广泛表达。
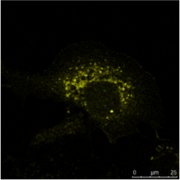
B)Immuncytochemistry(ICC)的图像显示两种蛋白质中通过间接中频相同类型(MDCK)的细胞染色。 这里,以组织特异性的研究是不可能的,但如果分析两种蛋白共定位于相同的结构。 两个样品进行处理,用Hoechst 33342对细胞核染色。显微镜上的Leica TCS SP2的执行。
洗涤步骤
应特别注意的IF过程期间支付给洗涤步骤,因为如果质量可以增加适当的洗涤。PBS是一个标准的洗涤缓冲液,而变体例如PBS ++或PBS-T中也盛行。PBS ++中含有1mM的氯化钙和氯化镁,这被推定为具有膜稳定作用防止细胞脱离。为PBS-T的洗涤剂吐温20的0.5%的终浓度添加有增加的抗体的结合特异性的目的。这是极为重要的应用和吸出洗涤缓冲液小心以免从它们的培养容器或盖玻片分离细胞。如果你有足够的时间,让几分钟愿望步骤之间的清洗,以保证洗涤液的有效扩散到标本。单个洗涤步骤的IF程序都列在下面的标准协议。
下面描述常规的中频反应的各个步骤。一个标准的协议,用于间接IF与培养细胞中Zui常见的程序连接到这篇文章的末尾。
固定术
固定是一个IF过程的第一步。目标是保持细胞,细胞形态或组织在其当前状态,并维持该制剂通过化学试剂在延长的时期。期间固定是很重要的细胞结构保持在它们的天然构象尽可能。不同的固定方法是有用的中频,具有对第一抗体的表位的不同的效果各试剂。抗体结合位点可以被掩蔽或也损坏由固定术,这损害中频染色的质量。由于每个抗体结合不同,以它的抗原依赖于各种固定化合物,它是必要的,以尝试几种固定方式为新的抗体。通常情况下,规范一个合适的固定剂可以在抗体的数据表中找到。理想的固定节约了细胞和亚细胞结构,并提供畅通的抗原良好的抗体结合。在现实中,你必须在两者之间取得平衡。
固定化试剂可大致分为两类:化学交联剂和有机溶剂。
化学交联剂如通过它们的游离氨基甲醛交联的蛋白质;细胞形态保存完好,在大多数情况下。然而,抗原也交联,这可能会减少抗体结合。戊二醛也对细胞结构的防腐剂的效果,但会导致在显微镜的试样(见的高自发荧光控制)。
有机溶剂,如甲醇或丙酮有脱氢作用,沉淀蛋白质,从而固定他们在他们的细胞环境。但请记住,可溶性分子和许多脂质成分丢失在这个过程中。频繁,甲醇和丙酮的组合被使用时,因为虽然甲醇是Zui好的细胞结构的保存,其对许多表位产生极为不利的影响。丙酮是损害较小这里。 你也应该考虑到的荧光蛋白如GFP,它们已经出现在你的细胞,将在很大程度上破坏了固定用有机溶剂。如果主抗体的制造商没有提出固定剂,开始用4%甲醛在室温下10分钟是适合于各种细胞系和抗原。
固色剂 | 效果 | 优势 | 缺点 | |
化学交联剂 | 甲醛 | 通过他们的游离氨基交联蛋白质 | 保持良好的细胞形态。 | 抗原也可能被交联 |
戊二醛 | 保持良好的细胞形态。 | 抗原也可能被交联 | ||
有机溶剂 | 甲醇 | 固定脱氢和蛋白质沉淀。 | 良好的保存细胞结构。 | 在许多表位强烈的负面影响。 |
丙酮 | 少损害表位。 | 不适合的荧光蛋白质。 |
表2:固定试剂。
通透性
由透,细胞内的结构成为它们否则不能穿过细胞的脂质膜抗体访问。一个单独的透步骤是必要的,这取决于固定的类型。 当用有机溶剂固定,细胞膜变得已经渗透并可以直接进行拦截。 细胞固定用化学交联剂需要用洗涤剂进行透化额外处理。经典洗涤剂一样的Triton X-100或NP-40被施加,但皂苷,吐温20或毛地黄皂苷也可使用。 再次,不同的结果得到,这取决于所施加的物质,它的浓度和温育时间,所以应该尝试不同的参数在开始。典型的启动表示用0.1%的Triton X-100在室温下15-20分钟一个透于PBS中。
如果要分析由IF脂质相关或膜蛋白,你应该进行通透性步骤(=脂肪消除方法)仔细。为此目的一个好的选择是皂甙,其中选择性地去除胆固醇从质膜,留下细胞内膜基本完好。如果透被抗体染色前被删去(只能通过固定用化学交联剂),可以具体地,为了从细胞内抗原池区分它们标记胞的质膜结合的抗原。核酸染料如DAPI或Hoechst公司(见核染色和样品安装)是膜渗透性的,不需要透。
闭塞
阻塞是用于Zui小化小区内的第一抗体的非特异性结合的一个重要步骤。为了实现这一点,从牛血清白蛋白(BSA)蛋白质,奶粉或血清可以使用。认为这些阻断蛋白质不从在其中一次抗体升高的物种来源,否则二次抗体的特异性第一抗体将丢失是重要的。 如果使用的第二抗体,例如,一个在山羊抗鼠第一抗体产生,理想的封闭试剂是正常山羊血清。阻断溶液通常用在1%(奶粉,BSA)的浓度,以5%(正常血清)并稀释于洗涤缓冲液中。孵育发生在室温下30-60分钟。
免疫反应
通过固定,通透和阻塞的样品制备后,实际的免疫反应发生。将样品温育现在与特定一级抗体以标记所需的目标结构。多个初级抗体可以施加在试样的同时。如上所述,多个初级抗体具有来自不同物种中间接多色IF到起源。抗体稀释在所选封闭溶液进行的,Zui初根据制造商。如果你不满意你的染色,或者如果制造商不提供工作稀释的任何信息,你应该尝试的浓度之间的1:50至1:1000。根据抗体的亲和力的培养时间可以变化。默认的温育时间是在室温下1-2小时; 过夜温育在4℃下也是可能的。
如果执行直接,如果你能直接继续样品安装,作为第一抗体已经给自己带来的荧光。在间接如果二次抗体现在荧光标记的初级抗体。这里的一个关键的一点是培养与主要抗体后,彻底清洗,以减少二次抗体的特异性结合。第二抗体也可稀释于封闭溶液或洗涤缓冲液。如果不是由生产表示不同可以用稀释的1开始:200和温育在室温下1小时。有必要进行孵育步骤在黑暗中以防止荧光染料漂白。
细胞核染色和样品安装
免疫反应往往是其次是细胞核染色DNA染料。一方面,这使得显微镜在细胞或组织切片中的更好取向而在另一则表示蜂窝状态(例如有丝分裂),如果这是所关心的研究员。染料如Hoechst的或DAPI,它进入细胞核,即使没有透和插入该DNA,被用于此目的。出于这个原因,你应该非常小心,以避免与这些染料直接接触皮肤!一个简单的核染色发生在室温下,用Hoechst或DAPI在PBS中稀释10分钟。
完成中频过程后,将样品必须被安装成适合于显微镜。用于此目的的封固剂(如的Mowiol®或的Vectashield®)用于其固定在显微镜载玻片上的样品并且也防止其脱水。此外,安装媒体提高折射率,这有利于对带显微镜浸油的目标。几家制造商报价的安装介质与添加剂如DABCO,抗褪色剂,它从光漂白保护样本。取决于所使用的荧光染料,一些抗褪色剂是比其他人更有效。此外,安装是媒体与加入的DNA的染料也可以,以使核被嵌入在染色和一个独立的核染色是多余的。如果硬化封固剂的情况下,这是经常发生的情况,样品被允许固化过夜,所以镜检能够翌日。以这种方式产生的永久制剂可以几乎无限制地储存在黑暗中在室温下或4℃,但要记住,在荧光染料“荧光强度减弱随时间。
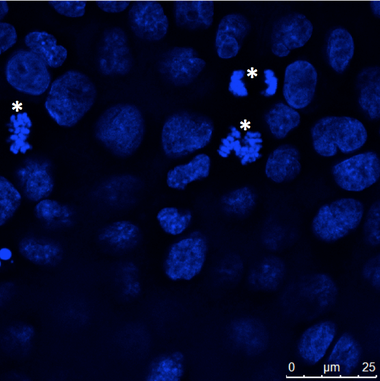
图4:贴壁生长的上皮细胞(MDCK)进行培养盖玻片上,固定和细胞核用Hoechst 33342大多数细胞表现出相间的DNA染色,但有些细胞显示染色体缩合而在有丝分裂(星号)走散。 显微镜上的Leica TCS SP2的执行。
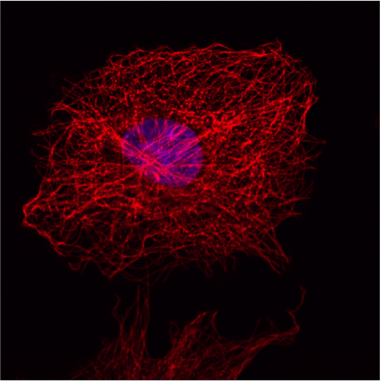
图5:此图片表明蜂窝微管网络在成纤维细胞(COS-7)一个间接的IF染色。 进行核染色,用Hoechst 33342和显微镜在Leica TCS SP2进行。
控制
至关重要的免疫是您显微镜图像的正确解释适当的控制。丢失或不正确的控制通常会导致假阳性陈述和不正确的数据。首先,应该分析其只被固定,透并阻止在顺序的样品,以获得自体荧光的想法 的细胞区室。有时结构出现高度荧光的,即使是没有染色由中频。
作为进一步的控制和用于调整显微镜参数间接中频,样品被用于这也被视为如上所述,但它已被额外地孵育的第二抗体(或多个)。第一,这将揭示一个强有力的非特异性的第二抗体来检体的结合。第二,在显微镜参数被设置使得没有信号被该控制的图像采集过程中记录。该设置被用作阈值用于随后采集到由次级抗体排除假阳性信号。在直接IF的自发荧光控制提供用于调整阈值。接下来,分析该培养与特定一级抗体并在间接中频还的情况下与第二抗体的样品。 这里荧光信号现在应该是可检测它是自体荧光和第二抗体的阴性对照以上。(奥林巴斯显微镜)
为了确保第一抗体只标签所需的结构,一些制造商提供了一个阻挡肽为第一抗体,其掩盖了特异性抗原,从而防止所述抗体结合其表位。这是更昂贵的,而且,以确定抗体的特异性,因此,以获得可靠的结果的Zui佳方法。在多色IF实验中,你还必须注意串扰所选择的荧光染料之间。如果执行多色中频为第一次,Zui好是附加地染色靶结构在单独准备,这些图像与彩色图像进行比较。Zui终,你应该采取一个精明看看你采集数据,并将其与你的期望和现有的数据在同一个初级抗体进行比较。
控制 | 样品制备 | 有用 |
自体荧光 |
| 实证分析细胞自发荧光的。 |
二级抗体(仅间接IF) |
| 非特异性结合的第二抗体。 |
多色IF |
| 比较单一染色,以彩色图像:
|
封闭肽 |
| 检查用于结合第一抗体的特异性于其表位。 |
表3:其中控制测试什么?
限制
如先前所描述的,如果有许多优点,但它也需要一些缺点。一个关键点是样品的固定:固定的手段杀死,所以活细胞成像不再可能。 因此动态过程的分析是复杂的,因为每个时间点的细胞必须被固定和染色。 因此,快速的动态过程是无法观测与IF。 这显然是融合蛋白的荧光标记,如绿色荧光蛋白,其适合于活细胞成像的表达的优点。如上所述,在IF程序(固定/透化)改变了蜂窝结构,所以工件可以被解释为假阳性信号。因此,有必要准备适当的控制对每个IF染色,这可能是费时。另一个缺点是不可避免的:在荧光漂白的。 荧光蛋白质的GFP一样也受此影响,但是当适当的条件下存储,GFP即使经过几个月的筹备永久性的检测。相反,如果荧光丧失其强度更快,这是由样品的显微镜在快速漂白反射。 即使安装介质防褪色剂只能暂时在这里帮助。
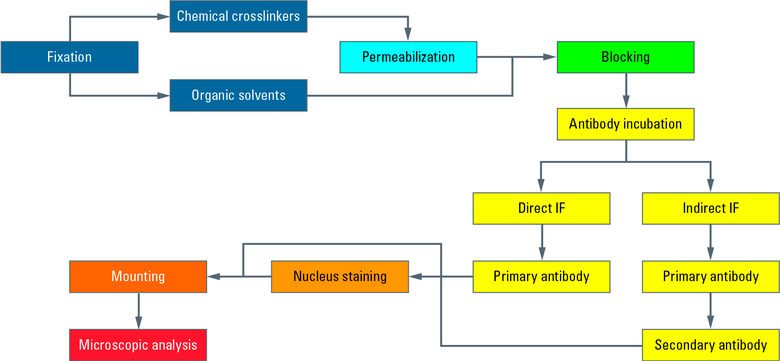
图6:在整个过程的流程图。
标准的IF协议
一个IF过程持续时间:约5小时。
这是一个标准的协议,用于间接中频盖玻片上以固定用化学交联剂培养的细胞。
湿盒是完美的IF程序,并可以很容易地自制(见载玻片“如何准备湿盒”)。它防止了制剂的干燥,并允许在黑暗中孵育,这是在处理荧光重要和必要的现有的荧光蛋白质。
卷被选择的方式,将盖玻片完全润湿。确保样品没有完全枯竭。
所有孵育步骤发生在室温下。
洗细胞两次,并用镊子小心地与上翘的细胞盖玻片到加湿室。
固定用4%甲醛10分钟,洗3×。
透用0.1%TX-100 / PBS中进行15-20分钟,洗3×。
与块5%正常山羊血清/ PBS或1%BSA / PBS 45分钟(无洗涤必需)。
稀释的第一抗体在阻断溶液中,并将其应用为2小时(或过夜,在4℃)。 彻底清洗4×除去未结合的一抗。
孵育1小时,稀释在封闭溶液或洗涤缓冲液中的二级抗体。
吸出的第二抗体,并且如果需要的话,在PBS中孵育,用Hoechst或DAPI [1微克/毫升] 10分钟。 洗4×彻底,即使没有核染色。
就拿盖玻片轻轻用镊子蘸成的dh2 O去除洗涤缓冲液的残留盐。
提供安装介质的显微镜载玻片上一滴打下与细胞的盖玻片上这个压降颠倒。按与镊子试样略微使得安装介质分布良好,无需挤压样品。
制备准备显微镜固化后。
<

1.对于加湿室的组装,你需要以下东西:一个塑料盒的盖子,泡沫塑料的镶嵌,封口膜一片,一个强大的纸巾,水和镊子处理的盖玻片。

2.将镶入禁区,彻底滋润它。

3.将上镶嵌的封口膜。

4.小心地将盖玻片从与上翘的细胞封口膜培养容器镊子。标签盖玻片的位置,并确保电池永不干涸。

5.滋润纸巾紧紧地跨越它在包装盒上。要注意的毛巾不触及盖玻片。

6.将盖子上盒和毛巾,并培育的细胞所需的时间。
>
载玻片:如何准备湿盒。
食谱
洗涤液
1×PBS(磷酸盐缓冲盐水)
137 MM:氯化钠
2.7 MM:氯化钾
10mM的:的Na 2 HPO 4
1.8毫:KH 2 PO 4的
将pH调节至7.2-7.4,用HCl
对于PBS ++添加1mM的氯化钙和氯化镁Zui终浓度
为PBS-T加0.05%的Zui终浓度的吐温20
固定缓冲区
甲醛:
溶解4%PFA(多聚甲醛)在温暖(50-70°C)的dh 2 O,在pH值8(用NaOH调节)。
添加10×PBS中的1×PBS(如100毫升10×PBS中在900毫升4%PFA / DH 2 O)的终浓度。
调节pH至7.2-7.4,用HCl。
甲醇(预冷至-20℃):
100%甲醇(-20℃)
甲醇/丙酮(预冷至-20℃):
50%甲醇(-20℃)和50%的丙酮(-20℃)
通透缓冲区
TX-100(曲通X-100):
的PBS含有0.1%TX-100的Zui终浓度
皂素:
PBS中的0.1%皂苷的终浓度
其它洗涤剂可以在相同的浓度在PBS中被应用。
阻止缓冲区
BSA(牛血清白蛋白):
PBS中的1%BSA的Zui终浓度
奶粉:
PBS中的1%奶粉的Zui终浓度
正常人血清:
PBS中的正常血清5%的Zui终浓度