中国科学家对肺癌提供了新诊断和靶向治疗方法
中国科学家最近报道了组蛋白乙酰化调节的长链非编码RNA被称为溶酶体细胞死亡调节因子( LCDR ) 在肿瘤存活中的关键作用,为肺癌提供了潜在的诊断和治疗靶点。
在中国科学院苏州生物医学工程技术研究所高山教授的带领下,这些科学家揭示了肺癌细胞中LCDR的敲除可以促进细胞凋亡。结果发表在PNAS上。
溶酶体参与细胞稳态,其失调与包括癌症在内的各种人类疾病有关。LncRNA 是长度超过 200 个核苷酸的非编码 RNA,其失调与癌症标志相关。它们通过与DNA、RNA 和蛋白质组装体(包括具有选择性剪接、RNA 稳定性、翻译等功能的异质核糖核酸蛋白 (hnRNP) 家族)相互作用来驱动癌症的生长和存活。
然而,lncRNA 和/或 hnRNP 是否参与溶酶体介导的癌症存活尚未阐明。
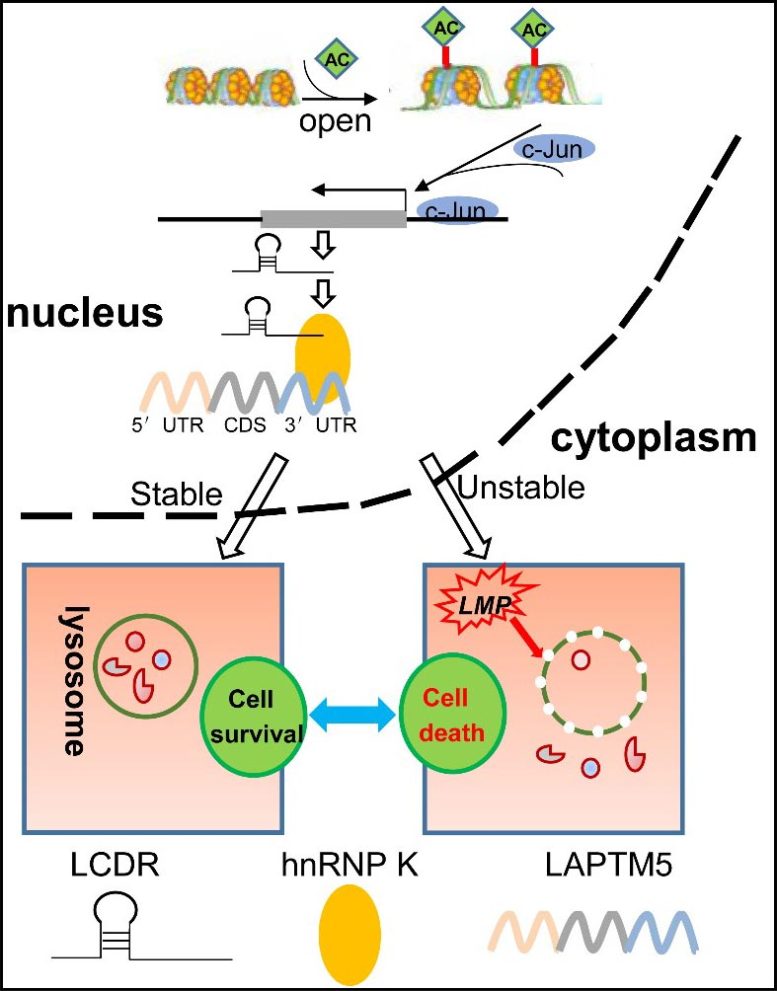
提出的促进肺癌发病机制的 LCDR/hnRNP K/LAPTM5 轴模型
在这项研究中,LCDR与异质核核糖核蛋白 K (hnRNP K) 结合,以调节维持溶酶体膜完整性的溶酶体相关蛋白跨膜 5 (LAPTM5) 转录物的稳定性。
据研究人员称,敲低LCDR、hnRNP K 或 LAPTM5 可促进溶酶体膜透化和溶酶体细胞死亡,从而导致细胞凋亡。LAPTM5 过表达或组织蛋白酶 B 抑制剂在体外和体内部分恢复了该轴对溶酶体细胞死亡的影响。
同样,靶向LCDR显着降低了患者来源的肺腺癌 (LUAD) 异种移植物的肿瘤生长,并使用纳米颗粒 (NPs) 介导的系统性 siRNA 递送导致显着的细胞死亡。
此外,LCDR /hnRNP K/LAPTM5 在 LUAD 组织中上调,它们的共表达对 LUAD 的诊断价值增加。
这些发现揭示了LCDR /hnRNP K/LAPTM5 作为潜在的治疗靶点,溶酶体靶向是癌症治疗中一种很有前景的策略。
参考文献:
“LCDR Q:0 通过 hnRNP K 稳定的 LAPTM5 转录物调节溶酶体膜的完整性并促进细胞存活”,2022 年 1 月 17 日,美国国家科学院院刊。
DOI: 10.1073/pnas.2110428119
该工作得到了国家自然科学基金、中科院战略性先导科技项目等的支持。