科学家发现母亲将某些遗传疾病带给孩子的原因

该研究可以作为新策略的基础,以确保后代不受此类疾病的影响。现有的治疗是姑息性的,旨在改善患者的生活质量或延缓疾病的进展。
发表在《科学进展》杂志上的一篇研究文章描述了一种机制,该机制有助于解释称为线粒体疾病的某些遗传疾病是如何从母亲传播给孩子的。它报告的研究可以作为新策略的基础,以确保后代不受此类疾病的影响。现有的治疗是姑息性的,旨在改善患者的生活质量或延缓疾病的进展。
线粒体是产生细胞所需的大部分化学能的细胞器。线粒体DNA (mtDNA) 包含 16,569 个可发生突变的核苷酸。其中一些突变可导致线粒体疾病的发展。
核 DNA(著名的双螺旋结构,编码大部分基因组)是从父母双方继承的,而 mtDNA 则仅从母亲那里继承。
相关推荐:观察分析改性沥青为什么要用荧光显微镜
出生时,女婴的卵巢已经包含了她将拥有的所有卵子。在青春期开始的生殖周期中,其中一些未成熟的卵子在激素的影响下发育,导致排卵并可能受精。
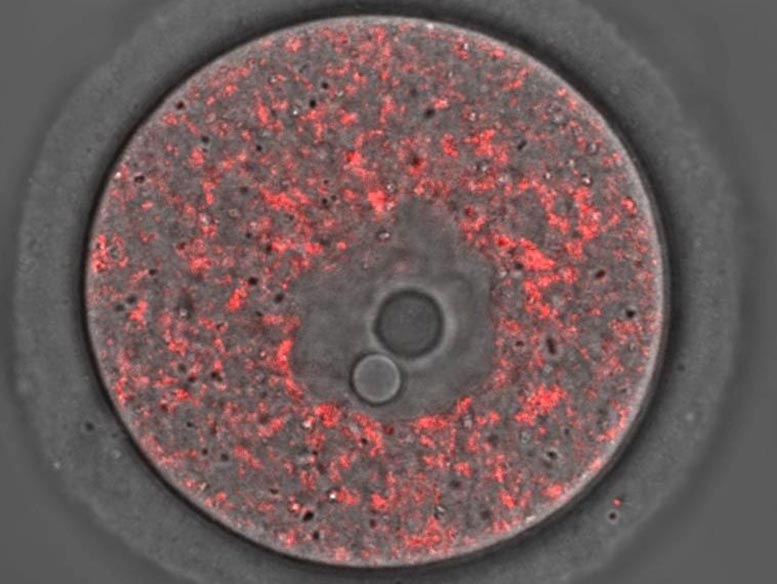
排卵前的未成熟小鼠卵子,线粒体染成红色。学分:马科斯·罗伯托·基亚拉蒂
该研究首次表明突变mtDNA在卵子形成的最后阶段积累。研究人员在小鼠身上进行了实验,报告称突变分子的比例随着卵子的成熟而增加,这些突变体会损害线粒体的功能,并导致疾病的发展。
研究人员发现,最多 90% 的 mtDNA 会发生突变。上限的存在对于了解突变 mtDNA 如何传播并导致疾病非常重要。
当突变型和野生型 mtDNA 在一个细胞中共存时(异质性),突变型 mtDNA 的影响可能会被掩盖,从而促进向后代的传播。“直到现在,没有人知道这种堆积是否发生,但我们的研究证明确实如此。现在我们了解了它发生的地点和方式,就有可能找到避免它的方法,”圣卡洛斯联邦大学 (UFSCar) 遗传学与进化系教授 Marcos Roberto Chiaratti 说。巴西,保罗。
Chiaratti 和研究生Carolina Habermann Macabelli 是该文章的作者之一。该研究由 FAPESP 通过两个项目(17/04372-0 和 16/07868-4)支持。
Chiaratti 还获得了英国医学科学院的牛顿高级奖学金。他与该文章的最后一位作者 Patrick Francis Chinnery 领导的小组合作。Chinnery 是剑桥大学神经病学教授,也是 Wellcome Trust MRC 线粒体生物学部门的首席研究员。
“最有效的治疗方法是识别母亲的突变,以防止孩子遗传。这是我们研究的背景,旨在验证哪些突变被传播并分析所涉及的机制。巴西对线粒体疾病的研究仍处于起步阶段,”Chiaratti 说。
线粒体疾病的症状因突变、受损细胞的数量和受影响的组织而异。最常见的包括肌肉无力、运动协调性丧失、认知障碍、脑退化以及肾或心力衰竭。
这种遗传性代谢疾病可以出现在任何年龄,但突变越早出现,就越有可能导致严重的症状甚至死亡。诊断很困难,通常需要进行基因和分子检测,因此缺乏有关患病率的统计数据。
据估计,由 mtDNA 突变引起的疾病影响全球每 5,000 人中至少有 1 人。然而,致病性 mtDNA 突变的频率约为 200 分之一。突变 m.3243A>G 会导致 MELAS 综合征(线粒体脑病、乳酸性酸中毒和中风样发作),发生在大约 80% 的具有致病性异质性突变。
实验
研究人员研究了具有两种线粒体基因组的转基因小鼠:野生型,不会引起疾病,致病性突变 m.5024C>T,类似于 m.5650G>A,一种存在于人类中的致病性突变。
对 1,167 对母鼠的分析发现,m.5024C>T 水平低的雌性具有将更高水平的突变传递给后代的强烈趋势。然而,在具有高水平突变的女性中,检测到了相反的趋势,这表明针对高水平突变(超过 90%)进行纯化选择。
对处于不同发育阶段的小鼠卵母细胞(未成熟卵子)的分析显示,m.5024C>T 水平高于野生型 mtDNA。这表明突变的 mtDNA 在卵母细胞成熟期间优先复制,无论细胞周期如何,因为卵子在排卵之前不会经历细胞分裂。
研究人员测试了几种数学模型,最能解释这一现象的模型指出了有利于突变 mtDNA 的复制优势和防止突变达到高水平的纯化选择。
他们首先测量了 42 名女性和 1,167 名后代的异质性。接下来,他们测量了不同发育阶段卵子中突变 mtDNA 的水平,并将其与不同年龄不同器官的突变水平进行了比较。
他们发现证据表明,该结果适用于携带另一种致病突变(m.3875delC tRNA)的小鼠和人类,正如对 236 对母子的分析所表明的那样。这表明当突变从具有低异质性水平的母亲传播并针对高异质性水平(超过90%)进行纯化选择时,正选择。他们得出的结论是,正选择是由于突变体的复制优先于野生型分子的复制。
“这种优先复制使突变水平达到了 90% 的上限,高于此上限,突变的负面影响太大,其他机制似乎作用于卵子以阻止它们达到 100%,”Chiaratti 说。
他计划很快前往英国进行新的实验。下一步可能是进入药物治疗阶段,目的是对抗 mtDNA 突变水平,以防止疾病传播。“一旦我们了解导致线粒体疾病的突变累积是如何在卵子形成的最后阶段发生的,我们就能够在体外生产卵子并在药理学和基因上操纵它们,以降低突变水平,降低孩子患上这种疾病的可能性,”他说。
参考文献:
“线粒体 DNA 异质性在卵母细胞发育传播突变传递过程中受到调节”,作者 Haixin Zhang、Marco Esposito、Mikael G. Pezet、Juvid Aryaman、Wei Wei、Florian Klimm、Claudia Calabrese、Stephen P. Burr、Carolina H. Macabelli、Carlo Viscomi、Mitinori Saitou、Marcos R. Chiaratti、James B. Stewart、Nick Jones 和 Patrick F. Chinnery,2021 年 12 月 8 日,科学进展。
DOI: 10.1126/sciadv.abi5657
